淺談銀屑病動物模型
銀屑病是什么,?
皮膚由三層:表皮,、真皮層和皮下層組成。每一層都有各種皮膚附屬物,,如汗腺,、直立肌和皮脂腺。健康的皮膚會形成皮膚層并不斷更新,,死皮脫落,,新皮再生,這就是我們所說的皮膚的自然更替,。而作為以T細胞介導為主的自身免疫性皮膚病,,銀屑病(Psoriasis),,又稱牛皮癬,,是一種慢性非感染性炎癥性皮膚病,復發(fā)性高,、可遺傳,,可能無法永久性治愈?;颊咂つw更新緩慢,,所以當新的皮膚層出現(xiàn)時,死細胞不會脫落,,形成死細胞(角化細胞)的斑塊或皮膚結(jié)痂,。 這些斑塊會引起疼痛、發(fā)炎,,甚至四分五裂,,產(chǎn)生傷口,可能出血也會形成鱗狀皮膚,。該病表現(xiàn)為軀體多處紅斑,、丘疹,覆以銀白色鱗屑,,發(fā)病不受年齡和地域限制,通常伴有糖尿病,、高血壓,、抑郁癥和非酒精性脂肪肝等疾病,;患者表皮過度增生,,皮膚中含有過多的免疫細胞,可產(chǎn)生大量的細胞因子,、趨化因子和炎癥分子,。
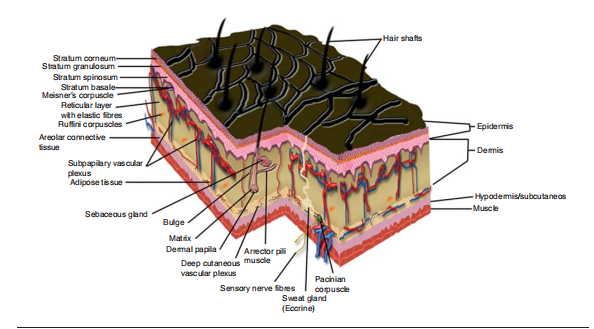
皮膚的結(jié)構(gòu)(DOI:10.1517/17460441.2013.761202)
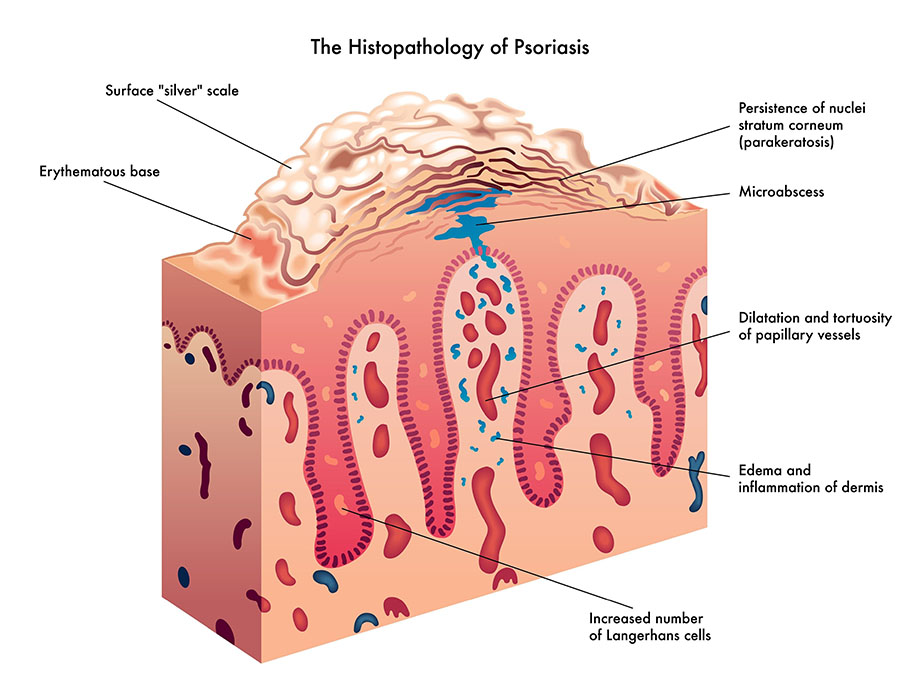
銀屑病的組織病理學結(jié)構(gòu)(https://blog.ho la.com/farmaciameritxell/)
患者的癥狀頑固,、病因錯綜復雜,嚴重的甚至會致殘,,給個人,、家庭及社會帶來嚴重困擾,其發(fā)病機制尚未闡明,,特別是在人類白細胞抗原HLA-C*06:02風險等位基因的存在下,,鏈球菌感染、壓力,、吸煙,、肥胖和飲酒等因素都會加重病情。銀屑病目前還不能治愈,,應(yīng)在疾病發(fā)展早期開展治療,,同時改善生活方式,從而盡量減輕痛苦,。
自20世紀80年代初以來,,T細胞在銀屑病發(fā)病機制中的重要性一直為人所知,許多經(jīng)典免疫細胞(包括樹突狀細胞和中性粒細胞)和非經(jīng)典免疫細胞(如角質(zhì)形成細胞)參與了疾病的發(fā)生,。這些細胞之間的通信主要通過細胞因子如TNFα,、IFN-γ、IL-17和IL-22發(fā)生,,并通過角質(zhì)形成細胞的激活,,驅(qū)動表皮的過度增殖和抗菌蛋白、生長因子和趨化因子的產(chǎn)生,。這些因素促進了銀屑病的特征性變化,,包括血管生成、中性粒細胞浸潤,、輔助T細胞1型(Th1)和Th17細胞數(shù)量的增加,,創(chuàng)造了一個自我維持的炎癥循環(huán)。這些是長期存在的非循環(huán)的記憶T細胞,,進化到能夠提供對病原體的快速保護的程度,,當被異常激活時,就會發(fā)揮作用,。免疫學和遺傳學研究已經(jīng)證明IL-17和IL-23是銀屑病發(fā)病的關(guān)鍵因素,。通過生物療法對這些細胞因子和TNFα的靶向免疫治療,能夠有效抑制疾病的發(fā)展,。
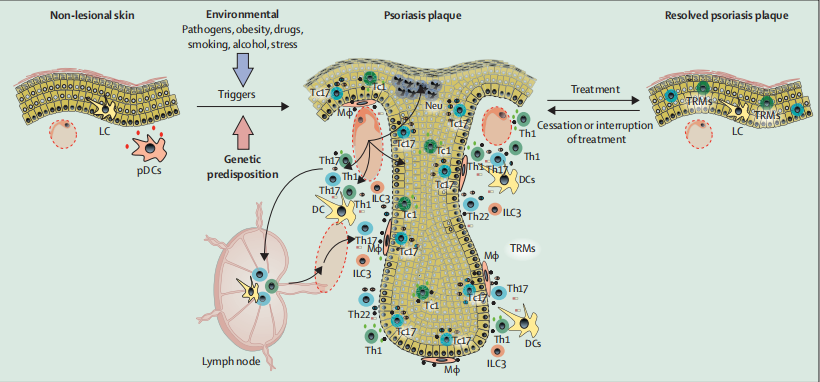
銀屑病的免疫發(fā)病機制和銀屑病斑塊(DOI:10.1016/S0140-6736(20)32549-6 )
而新藥的開發(fā),、探究和臨床前CRO,都需要一個比較理想的動物模型,,相應(yīng)的,,它還應(yīng)具有 以下的特征①相似的臨床表現(xiàn),,如組織學性狀和病理學情況;②炎癥因子增多,、血管化程度加深,;③對銀屑病常用藥物敏感。
如何應(yīng)對,?
那現(xiàn)在都有哪些銀屑病動物模型可供選擇呢,?小鼠模型可分為自發(fā)、基因工程(轉(zhuǎn)基因和敲除),、異種移植和直接誘導,。
一、基因工程小鼠:
采用基因編輯技術(shù),,過表達或敲除動物體內(nèi)某種特定基因,。KRT5-JunB/Jun 缺陷小鼠,具有與相似的皮膚炎癥和關(guān)節(jié)炎表現(xiàn)] ,;KRT14-IKKβ 缺陷小鼠,,皮膚炎癥明顯、表皮增厚,、分化異常,;白細胞介素1α轉(zhuǎn)基因小鼠模型,患關(guān)節(jié)炎,,毛發(fā)脫落,,身形消瘦,皮膚皺縮,,還伴有動脈炎癥,。
二、自發(fā)疾病性動物模型:
在自然條件下出現(xiàn),,或者經(jīng)遺傳育種篩選得到的由于基因突變的產(chǎn)生的動物模型,。目前發(fā)現(xiàn)的自發(fā)產(chǎn)生銀屑病樣病變的動物模型存在各種問題,尚未廣泛使用,,如Ttcfsn/ Ttcfsn鼠,,會自發(fā)表現(xiàn)為皮膚鱗屑、炎癥,、角化過度的形狀,,但其生長周期短,加之表皮生長因子受體和IgE抗體水平高,,且對常見的銀屑病治療藥物無應(yīng)答機制;ic/ic突變鼠,,病理表現(xiàn)與臨床結(jié)果不同等,。
三,、異體移植動物模型:
該模型可通過異種移植模型和同種不同品系小鼠間移植獲得。前者的實驗設(shè)計是將人體組織或細胞移植給免疫缺陷小鼠,,如裸鼠(T 淋巴細胞免疫缺陷鼠),、SCID 小鼠(體液和細胞免疫雙重缺陷小鼠)和AGR129 小鼠( T 淋 巴細胞、B 淋巴細胞和成熟的 NK 細胞缺失),,目前最常用于新藥研發(fā)的是SCID 小鼠,,但其成本較高,對操作手法和實驗環(huán)境有嚴苛的要求,。
后者的實驗方案的疾病復制效果并不佳,,且小鼠種間的差異,會干擾到實驗結(jié)果的評判,,不建議采用,。
四、急性炎癥動物模型:
該模型可由藥物誘導和的皮膚損傷兩種方式獲得,。藥物誘導的方法有:局部外用,、真皮內(nèi)注射和口服。咪喹莫特(IMQ)作為Toll樣受體(TLR)7/8的激動劑,,既能基本復制皮膚損傷的表型,,也能使實驗動物的免疫功能降低,這是與銀屑病病人相似的,,因而被廣泛使用,。而其他造模方法如真皮內(nèi)注射白細胞介素;對小鼠造成機械損傷等,,已逐漸棄用,。
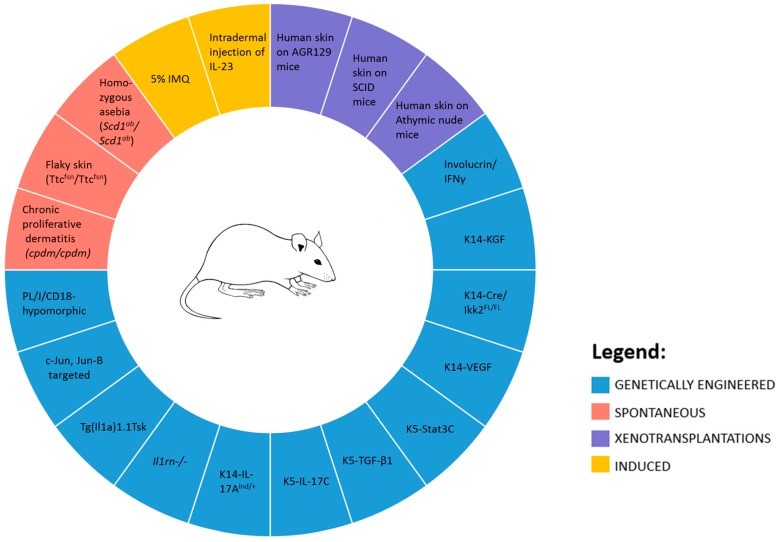
用于銀屑病研究的小鼠模型(DOI:10.3390/ijms18122514)
拓普怎么做?
為了“讓天下沒有難治的疾病”這一愿景盡快落地,,拓普生物已經(jīng)打磨出一套成熟的IMQ誘導造模的實驗方案,。
實驗動物:
SPF級BALB/c 小鼠,6-8 周齡
實驗方法:
1. 小鼠經(jīng)適應(yīng)性飼養(yǎng)一周后,,進行隨機分組(實驗組和對照組),,然后背部脫毛;
2. 在皮膚暴露區(qū)涂抹 5%的IMQ 軟膏,,予同等劑量的凡士林軟膏處理,,連續(xù)6天;
3. 實驗期間需每日觀察小鼠的一般狀態(tài),,包括進食進水,、活動度、皮毛色澤等,如有死亡應(yīng)該及時記錄,;為評估皮損嚴重程度,,采用改良的銀屑病皮損面積和嚴重程度指數(shù)(PASI)法,包括紅斑,、鱗屑,、皮膚厚度三項指標,以0~4分進行計分(見表1),。評分頻率為1天1次,。
表1 PASI評分標準
0 | 1 | 2 | 3 | 4 | |
紅斑 | 無紅斑 | 紅斑呈淡紅色 | 紅斑呈紅色 | 紅斑呈深紅色 | 紅斑極深 |
鱗屑 | 表面無可見鱗屑 | 分為部分皮損表面上覆有鱗屑,以細微的鱗屑為主 | 大多數(shù)皮損表面完全或不完全覆有鱗屑,,鱗屑呈片狀 | 皮損部位幾乎全部被鱗屑覆蓋,,鱗屑呈層 | 皮損部位全部被鱗屑覆蓋,鱗屑很厚成層 |
厚度 | 皮損與正常皮膚齊平 | 皮損較正常皮膚表面稍高 | 皮損中等度隆起,,斑塊的邊緣為圓或斜坡型 | 皮損肥厚,,隆起明顯 | 皮損高度肥厚,明顯凸起 |
4. 小鼠處死后取下造模區(qū)域處的皮膚組織,,取一部分固定在福爾馬林中,,可用于后續(xù)的病理檢測。
5. 小鼠皮損組織ELISA檢測
取小鼠部分皮損組織,,冰上勻漿后離心取上清,,ELISA法測定上清中IL-23、IL-17,、IL-22,、TNF-α、IFN-γ的含量,。
實驗結(jié)果:
1. 表型觀察:
經(jīng)IMQ處理的小鼠,,造模開始后0-6d,皮膚逐漸變厚,,并伴有紅斑,、干燥銀白色鱗屑,皮膚松弛且損傷嚴重,。
2. 病理結(jié)果:
模型組小鼠背部皮膚和表皮厚度的表型表現(xiàn)及相應(yīng)的組織學分析(H&E染色,,x200),有明顯的棘皮增生,、角化不全,、膿皰和脫屑,炎癥性白細胞浸潤真皮,。
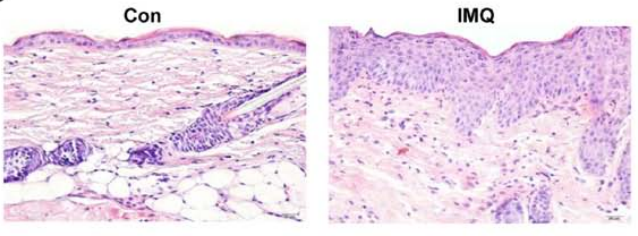
對照組和實驗組 BALB/c小鼠的HE染色結(jié)果( DOI: 10.3892/ijmm.2017.2930)
高達90%的新藥研發(fā)在臨床III期失敗,,主要原因是缺乏臨床療效,,這表明具有高度預測性和可操作性的人類疾病動物模型是非常重要的。在慢性炎癥反應(yīng),、炎癥循環(huán)和免疫代謝動力學的研究中,,銀屑病動物模型將有更多應(yīng)用,,有助于開發(fā)新的治療方法,。



