如何獲得高質(zhì)量免疫組化(IHC圖像)

由于免疫組化染色過程中存在很多步驟或環(huán)節(jié),,每一個步驟或環(huán)節(jié)都可能影響到染色的最終結(jié)果,,因此,要做好一張高質(zhì)量的免疫組化切片并不是一件非常容易的事,,下面總結(jié)了幾點小問題,,希望能給到幫助。![]()
組織取材要快,不宜過大,,太大太厚的組織不利于均勻一致的固定,,取材厚度應(yīng)小于5mm,避免人為損傷,。
![]()
固定的目的是①防止標(biāo)本從玻片上脫落,;②除去防礙抗原-抗體結(jié)合的類脂,使抗原抗體結(jié)合物易于獲得良好的染色結(jié)果,;③固定的標(biāo)本易于保存,。組織取材后應(yīng)即刻固定,常用固定液有中性甲醛,、4%多聚甲醛(推薦使用),,固定體積10倍于組織,固定時間6-24小時,,固定時間不夠或過長,,都有可能引起抗原丟失,。
![]()
切片的質(zhì)量關(guān)系著免疫組化染色好壞,,保持切出的組織完整、平整,,切片皺褶,、邊緣卷曲會造成之后試劑難以洗凈,顯色時這些區(qū)域著色會增強,。
![]()
三級二甲苯脫蠟,,每次脫蠟15分鐘,脫蠟徹底,,二甲苯使用次數(shù)不宜太多,,每100張片子更換一次(每周更換一次也是可以的)。
![]()
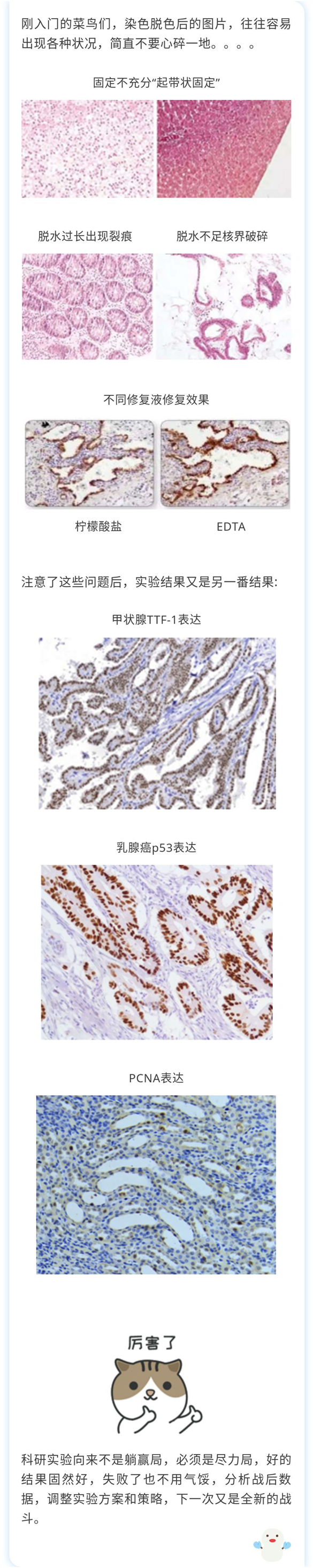
由于組織中部分抗原在甲醛或多聚甲醛固定過程中,,發(fā)生了蛋白之間交聯(lián)及醛基的封閉作用,,從而失去抗原性;通過抗原修復(fù),,使得細(xì)胞內(nèi)抗原決定族重新暴露,,提高抗原檢測率。修復(fù)方法有酶修復(fù),、高壓熱修復(fù),、微波熱修復(fù),不同抗原有各自最適的修復(fù)方式,,對大多數(shù)的抗原來說微波熱修復(fù)都能得到很好的效果,。對于修復(fù)液大多數(shù)使用PH6.0的檸檬酸鈉修復(fù)液,但大多數(shù)的抗體使用EDTA(PH8.0或9.0)修復(fù)液效果好于PH6.0的檸檬酸鈉修復(fù)液![]()
一抗孵育條件在免疫組化反應(yīng)中最重要,,包括孵育時間,、溫度和抗體濃度,。一抗孵育溫度有幾種: 4 度、室溫,、37 度,,其中 4 度效果最佳;孵育時間:這與溫度,、抗體濃度有關(guān),,一般 37 度 1-2h,4 度過夜(從冰箱拿出后 37 度復(fù)溫 45min) ,。具體條件還要摸索,。二抗孵育條件:二抗一般室溫或 37 度 30min-1h,具體時間需要摸索......
![]()
顯色液應(yīng)現(xiàn)配現(xiàn)用,,肉眼或顯微鏡下觀察,,當(dāng)有明顯棕色出現(xiàn),應(yīng)終止顯色,,顯色時間不宜過長造成背景染色,。